-مهندسی بافت
یکی از چالش هایی که علم پزشکی از گذشته
تاکنون با آن مواجه بوده است درمان بافت های آسیب دیده ی
بدن می باشد. مهندسی بافت از علوم زیستی و مهندسی
برای تولید جایگزین های زیستی برای
بافت های آسیب دیده استفاده می کند. در سال 1993 یک
دانشمند به نام باب لنگر تعریفی از مهندسی بافت ارائه داد:"
مهندسی بافت یک علم بین رشته ای است که با استفاده از
علوم مهندسی و زیستی اجزای بیولوژیکی
را بهبود می بخشد به شکلی بتوان بافت را بازسازی و
نگهداری کرد و عملکرد آن را بهبود بخشید". برای
شکل دهی بافت جدید باید سلول (سلول بنیادی و
یا سلول های تمایز یافته بافت مورد نظر) را بر روی
سطحی که بتواند ماتریکس خارج سلولی (ECM)
را شبیه سازی کند کشت داد. ماتریکس خارج سلولی
شبکه ای از زنجیره های گلیکوزآمین گلیکن شامل
تعداد پروتئین فیبریل و فیبر است. ماتریکس خارج
سلولی دارای محل های اتصال خاص (ligands) می باشد که بر چسپندگی
سلولی موثر است. غشای پایه نیز اتصال بین بافت
همبند و سایر بافت ها ایجاد می کند. غشای پایه شامل
اجزای ECM مانند هیالورونیک اسید،
فیبرهای کلاژن، لامینین، فیبرونکتین و
پروتئوگلیکن ها می باشد. بنابراین شبیه سازی ساختار
ماتریکس و ترکیب مواد طبیعی آن، یکی از
اصلی ترین نیازها در ساخت داربست های مهندسی بافت
می باشد. یکی از رویکردهای مهم در مهندسی
بافت ساخت داربستی است که بتواند بستری برای رشد و تمایز
سلول ها فراهم کند. مهمترین مواردی که برای داربست
مهندسی بافت باید توجه شود عبارتند از چسپندگی سلولی،
فیلتراسیون، تکثیر، تمایز و تولید بافت جدید
در سه بعد. داربست ها همچنین باید در گذر زمان تجزیه شوند و
سرعت تجزیه ی آن باید با سرعت بازسازی بافت هماهنگ باشد. امروزه
نانوفیبرهای الکتروریسی شده به علت نسبت سطح به حجم بالا،
زیست سازگاری و زیست تخریب پذیری (با توجه به
پلیمر الکتروریسی شده)، استحکام مکانیکی و تخلخل به
یکی از گزینه های اصلی برای ساخت داربست در
مهندسی بافت بدل شده اند. این داربست های نانوفیبری
با شبیه سازی ساختار ماتریکس خارج سلولی محیط را
برای رشد و اتصال سلول فراهم می کند. همچنین کامپوزیت های
نانوفیبری حاوی موادی مثل کلاژن و گلوکزآمین
گلیکون ها می توانند برهمکنش سلول-سلول و سلول-ECM را بهبود بخشند[1-4].
سلول های مختلفی بر روی
داربست های نانوفیبری کشت داده شده و نتایج موفقیت آمیزی
نیز بدست آمده است. تغییرات قطر، جهت گیری و ترکیبات
سازنده نانوفیبرها، تاثیرات مهمی بر روی چسپندگی و رشد
سلول ها دارند. قطر فیبرها، تخلخل و جهت گیری (رندوم یا
همراستا) نانوفیبرها را می توان بخوبی کنترل کرد تا به
نتایج مطلوب تری در کشت سلول دست یافت. تا بحال داربست های
نانوفیبری در بازسازی بافت های مختلفی مانند عصب، استخوان،
رگ، غضروف، تاندون / رباط و پوست مورد استفاده قرار گرفته
است[1]. در یک مطالعه از ترکیب کیتوزان و PCL برای ساخت
داربست نانوفیبری به شکل رندوم و همراستا استفاده شد که
روی آن سلول عضله کشت داده شد. برای مقایسه، فیلم این
ترکیب نیز برای کشت سلول استفاده شد. نتایج نشان داد که
چسپندگی سلول و موروفولوژی آن ها روی نانوفیبر بهتر از
فیلم بوده است. همچنین مشخص نتایج کشت روی داربست همراستا
بهتر از رندوم بود چراکه در ماتریکس طبیعی عضله جهت گیری
سلول ها و رشته همراستاست[5].
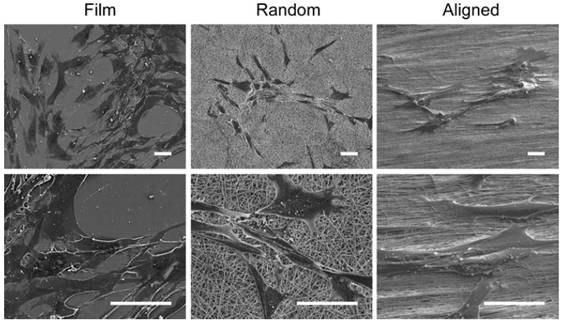
(شکل 1) کشت سلول عضله روی
فیلم و داربست های نانوفیبری پلی کاپرولاکتون/کیتوزان
بصورت رندوم و همراستا [5]
مطالعات نشان داده اند که سایز نانوفیبرها روی چسپندگی و
تکثیر سلول ها اثر می گذارد. برای نمونه فیبرهایی کربنی با
سایز 60 تا 200 نانومتر منجر به افزایش تکثیر و اتصال
استئوبلاست، افزایش فعالیت آلکالین فسفاتاز و ترشح ECM می
شوند. همچنین می توان از ساختارهای نانوفیبری هسته-پوسته
(Core-shell) برای انکپسوله کردن مواد بیولوژیکی هم چون
فاکتور رشد یا عوامل موثر روی تمایز سلول استفاده کرد. در
این صورت این مواد از فیبر خارج شده و در دسترس سلول کشت
داده شده روی داربست قرار می گیرند [6, 7].
سلول های بنیادی سلول های تمایز نیافته هستند که می تواند
به مدت طولانی سلول های مشابه خودشان را بسازند و به یک
رده ی سلولی خاص تمایز پیدا کنند (وقتی شرایط برای تمایز
به یک نوع سلول خاص فراهم شود). سلول های بنیادی به علت
شرایط ویژه ای که از نظر تکثیر دارند به شدت مورد توجه
مهندسی بافت قرار گرفته اند. در زیر مراحل کشت سلول بنیادی
بر روی نانوفیبرها جهت مهندسی بافت پوست آورده شده است.
زخم های عمیق/زخم ناشی از دیابت می تواند با استفاده از
داربست نانوفیبری حاوی سلول بنیادی و تزریق سلول بنیادی به
محل زخم درمان شود[8].
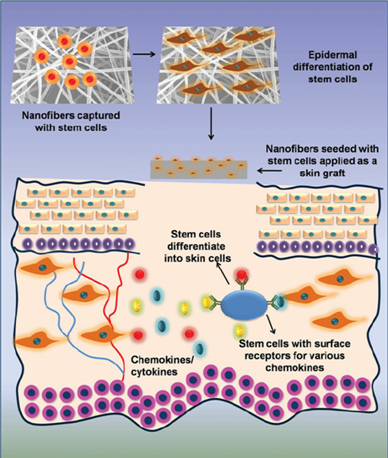
(شکل 2) مراحل کشت سلول
بنیادی روی داربست های نانوفیبری و استفاده از آن برای
پیوند پوست[8]
2-رهایش دارو و ژن رسانی
هدف از انتقال دارو این است که مقدار تعیین شده از داروی
خاص در زمان معین و با نرخ رهایش کنترل شده به بافت یا
سلول های خاصی منتقل شود. انتقال دارو از طریق نانوفیبرهای
الکتروریسی شده، برای مهندسی بافت مناسب است. بر این اساس
رهایش دارو با افزایش سطح دارو و حامل بیشتر می شود. رهایش
دارو در نانو الیاف الکتروریسی شده در مقایسه با فیلم ها،
به دلیل نسبت سطح به حجم بالاتر، با کنترل بهتری صورت می
گیرد. مدل رهایش دارو از نانوفیبرها به نحوه پراکندگی دارو
در فیبر بستگی دارد[1]. دو مدل کلی برای رهایش دارو از
نانوفیبرها ارائه شده است:
• مدل ماتریسی (حل شدن دارو در محلول قبل از الکتروریسی)
• مدل مخزنی (الکتروریسی نانوفیبرهای هسته پوسته)
با استفاده از نانوفیبر نوکلئیک اسیدهای ویروسی و غیر
ویروسی نیز منتقل می شوند. میزان موفقیت در انتقال ژن
ویروسی با پارامترهایی نظیر ساختار ژن، نوع سلول و ویروس و
تکنیک انتقال تعیین می شود. برای انتقال ژن در محل به یک
حامل جدید و کارامد نیاز است. در مقایسه با انتقال ژن
ویروسی، انتقال ژن غیر ویروسی دارای سمیت کمتر است و
پتانسیل بالایی برای نمونه های DNA بزرگ دارد. نانوفیبرهای
الکتروریسی شده بعنوان داربستی برای انتقال اسیدنوکلئیک
(DNA وsiRNA) استفاده شده اند چراکه دارای ویژگی ها مناسبی
همچون تخلخل بالا، سطح بالا، منافذ مرتبط باهم برای انتقال
آب و غذا و مهاجرت سلول ها می باشد. کپسوله شدن نامناسب و
کارایی کم یکی از مشکلات کپسوله کردن DNA در ساختارهای
نانوفیبری است که برای غلبه براین مشکلات از ساختارهای
هسته پوسته و اصلاحات سطحی استفاده شده است[9-11].
گروه دیگری از مواد که می تواند با استفاده از نانوفیبر
منتقل شود، فاکتورهای رشد GFs می باشد. این فاکتورها
می توانند روی رشد، تکثیر، مهاجرت و تمایز سلولی، انتقال
سیگنال بین سلول ها و ماتریکس موثر باشند و منجر به بهبود
بازسازی بافت شوند. ادغام نانوفیبر با این فاکتورهای رشد،
روی نتایج کشت سلول روی داربست مصنوعی تاثیر زیادی خواهد
داشت. تکنیک های مختلفی برای ادغام فاکتورهای رشد با
نانوفیبر وجود دارد مانند الکتروریسی هسته پوسته، اصلاح
سطح، ترکیب کردن و الکتروریسی امولسیون که هرکدام به میزان
متفاوتی نتیجه بخش است[12].
3-پروتزهای پزشکی
پروتز به اندام مصنوعي گفته مي شود كه جايگزين عضو یا قسمت
های از دست رفته بدن فرد مي شود. امروزه استفاده از
نانوفیبر در ساخت پروتزهای بافت های نرم مورد توجه قرار
گرفته که برای نمونه می توان به رگ های خونی ساخته شده از
نانوفیبر اشاره کرد. همچنین برای بهبود زیست سازگاری و
جلوگیری از واکنش های بعد از قرارگیری پیوند در بدن، می
توان پروتزهای سخت را نیز با لایه ای از نانوفیبر زیست
سازگار پوشش داد. این کار منجر می شود که سازگاری پروتز
قرار داده شده با بدن افزایش یابد.
در تصویر زیر فرایند الکتروریسی برای ساخت رگ مصنوعی نشان
داده شده است. این گونه پروتزها یکی از بارزترین کاربردهای
نانوفیبر در ساخت پروتز است. همانطور که مشخص است برای جمع
آوری نانوفیبر الکتروریسی شده باید از یک میله با قطری
مشابه عروق خونی استفاده کرد[13].
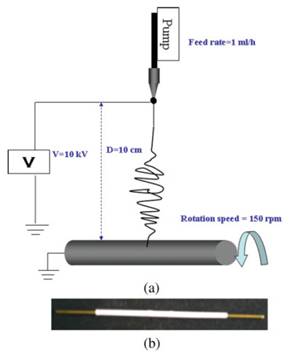
(شکل 3) a) فرایند
الکتروریسی برای ساخت رگ مصنوعی b) تصویری از رگ ساخته شده
از نانوفیبر[13]

(شکل 4) a.b) تصاویر رگ
ساخته شده با استفاده از نانوفیبر PLLA . c) تصویر سه بعدی
از نمونه و d) برشی عرضی از رگ[13]
از دیگر از اندام های لوله ای شکل بدن که با استفاده از
نانوفیبر نمونه ی مصنوعی آن ساخته شده است، نای و مری
می باشد. همانطور که در شکل 5 مشاهده می شود مری مصنوعی با
استفاده از الکتروریسی PET/PU و نانوفیبرهای کلاژن ساخته
شده است[14].

(شکل 5) پروتز کامپوزیتی سه
بعدی ساخته شده از نانوفیبر/میکروفیبر PET/PU و نانوفیبر
کلاژن و تصویر میکروسکوپی آن[14]

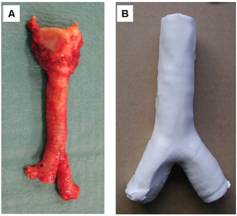
(شکل 6) A) نای طبیعی. B)
نای الکتروریسی شده. C) تصویر میکروسکوپی نای طبیعی و D)
تصویر میکروسکوپی نای سنتز شده[14]
4- بیوسنسورها
اولین بار مفهوم بیوسنسور در سال 1960 توسط Clark و Lyons
ارائه شد. از آن زمان تلاش های زیادی برای ساخت و بهبود
این گونه سنسورها در کاربردهای تشخیص کلینیکی، تحقیقات
دارویی و بررسی محیط صورت گرفته است. یک بیوسنسور یک سیستم
آنالیتیکی(تحلیلی) است که برای تشخیص و یا اندازه گیری
حضور یک ماده طراحی می شود. هر بیوسنسور دو بخش دارد: یک
عنصر شناسایی (پروتئین، DNA و یا RNA) که اتصالی انتخابی
با یک ماده ی بخصوص بر قرار می کند و یک مبدل (transducer)
که این اتصال را به سیگنال الکتریکی قابل اندازه گیری
تبدیل می کند[15].
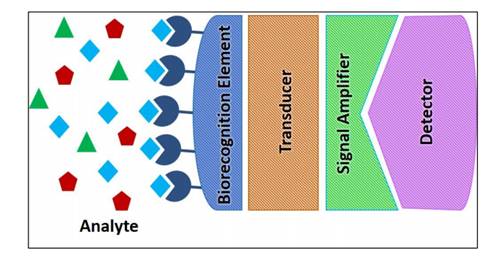
(شکل 7) تصویر شماتیکی از
بیوسنسور
مبدل ها یا همان ترانسدیوسرها بر اساس سیگنال تشخیصی به
چهار گروه اصلی تقسیم می شوند:
1. الکتروشیمیای (آمپرومتر و پتانسیومتر)
2. نوری (رنگ سنجی، فلوئورسنت، لومینه سنت و انترفرومتریک)
3. برپایه جرم (پیزوالکتریک و موج صوتی)
4. کالری سنج
در شکل زیر تقسیم بندی کلی بیوسنسورها آورده شده است.
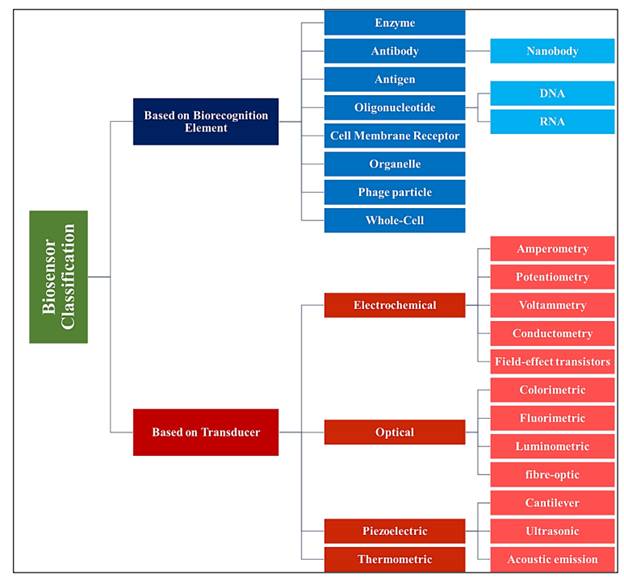
(شکل 8) انواع بیوسنسورها
براساس مبدل و اجزای تشخیصی
در طول دو دهه ی اخیر
استفاده از نانوساختارها در ساخت بیوسنسور به شدت مورد
توجه قرار گرفته و مقالات زیادی در این باره منتشر شده است.
نانوساختارها مانند نانوفیبرها خواص فیزیکوشیمیایی،
مکانیکی، اپتوالکترونیک و مغناطیسی منحصر به فردی دارند که
در حدفاصل های نانویی که ایجاد می کنند منجر به افزایش
حساسیت سنجش در سنسورها می شود. با استفاده از آن ها
بیوسنسورهای بسیار حساس و دستگاه-های تشخیص ultrasensitive
ساخته می شود. در زیر خلاصه ای از کاربردهای نانوفیبرها در
ساخت بیوسنسور آروده شده است[16].
بیوسنسورهایی بر پایه نانوفیبر
بیشتر سنسورها به سطح زیاد و ساختار متخلخل نیاز دارند تا
دسترسی سریع به آنالیت فراهم شود و نسبت سیگنال به نویز
افزایش یابد. ساختارهای نانوفیبری بخوبی با این نیازها
همخوانی دارند. با استفاده از الکتروریسی می توان مواد
تشخیصی متنوعی (مانند پلیمرهای عملکردی و اکسیدهای غیرآلی)
را به نانوفیبر تبدیل کرد. ویژگی های نانوفیبر با افزودن
یک دوپانت، موادشیمیای کاربردی و یا پلیمری خاص به محلول
الکتروریسی به راحتی قابل اصلاح و بهبود است. نانوفیبرهای
رسانای یا نیمه رسانا می توانند بطور مستقیم از الکتروریسی
ساخته شوند. در ادامه انواع گوناگون نانوفیبرهایی که در
ساخت سنسور مورد استفاده قرار گرفته-است را بررسی
می کنیم[16].
بیوسنسورهایی برپایه کربن نانوفیبر
کربن نانوفیبر (CNFs) پایداری و رسانایی مشابه نانو
لوله های کربنی (CNTs) دارد. در سال های اخیر نانوفیبرهای
کربنی به علت ساختار فیزیکی و شیمیایی (رسانایی، مساحت سطح،
ویژگی های شیمیایی ذاتی و یا ویژگی های القا شده و
زیست سازگاری) خاصی که دارند در ساخت بیوسنسور استفاده
شده اند. برای نمونه با استفاده از کربن نانوفیبر
بیوسنسورهای برای تشخیص گلوکز ساخته شده است. با استفاده
از تثبیت مستقیم آنزیم روی CNF فعال بیوسنسور ساخته می شود
که این یک روش کارامد و مناسب برای ساخت سنسورهای
الکتروشیمیایی با حساسیت بالا، مقاوم و قابل استفاده مجدد
است[17].
آقای Wu و همکارانش یک سنسور آمپرومتریک بر پایه
نانوفیبرهای کربنی ساخته اند که فعالیت کاتالیتیکی خوبی
برای CNF محلول نشان داده است. این نمونه سنسور با اصلاح
با نیتریک اسید، همراه با احیای الکتریکی اکسیژن حل شده در
پتانسیل کم ساخته می شود. غشای کربن نانوفیبری پایداری
بالایی دارد و به اکسیژن حل شده به سرعت پاسخ می دهد.
استفاده از پتانسیل عمل کم و غشای نافیون (Nafion) نیز
برای تشخیص گلوکز نتیجه بخش بوده است.
در مطالعه ی دیگری که توسط Li و همکارانش انجام شد تاثیر
میکروساختار CNF بر روی حساسیت الکتروشیمیای در تشخیص
هیدروژن پراکساید بررسی شد. مشخص شد که بسته به تنوع
مورفولوژی، بافت و ساختار کریستالی نانوفیبرهای کربنی،
نتایج متفاوتی در فعالیت الکتروکاتالیتیکی برای تشخیص H2O2
بدست آمد[18].
بیوسنسور آمپرومتریک اوریک اسید با استفاده از تثبیت
اوریکاز روی کامپوزیت کیتوزان و نانوفیبرکربن/نانوتیوب
الکتروریسی شده ساخته شده است. این کامپوزیت بر روی
الکترودی از جنس طلا که روی آن لایه ای از نانوذارات نقره
لایه نشانی شده قرار می گیرد. این سنسور در شرایط اپتیمم،
غلظت یک میکرومول از اوریک اسید را تشخیص می دهد.
نانوفیبرهایی برپایه اکسید فلز
تاکنون نانوفیبرهای الکتروریسی شده ی فلز/اکسید فلز، کربن
و کامپوزیت نانوفیبری بطور موفقیت آمیز برای ساخت سنسور
مورد استفاده قرار گرفته است. الکتروریسی یک روش ایده آل
برای ساخت حسگرهایی با حساسیت بالا از نانوفیبرهای پلیمر/اکسید
فلز (ZnO، TiO2 و NiO) زیست سازگار و زیست تخریب پذیر
می-باشد. برای مثال سنسورهای گلوکز، کلسترول، اوره، کاتکول،
LDL، تری گلیسیرید، دوپامین و مارکرهای سرطان با استفاده
از نانوفیبرها ساخته شده اند[19, 20].
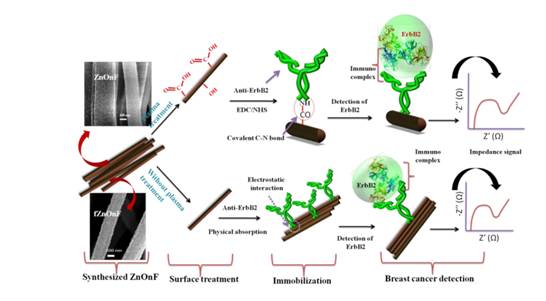
(شکل 9) تصویر شماتیکی
ازساخت ایمونو سنسور برای بیومارکرهای سرطان سینه (label
free)[19]
سنسورهایی بر پایه پلیمرهای رسانا
پلیمرهای رسانا بعنوان الکترود در سیستم های حسگر مورد
بررسی قرار گرفته اند. اخیرا بیوسنسورهایی برپایه
ترانزیستورهای اثر میدان (FET) به علت ویژگی های مناسب آن
همچون هزینه کم، پاسخ سریع، عملکرد راحت، حساسیت بالا و
عملکرد بدون نیاز به برچسپ مورد توجه قرار گرفته اند. برای
کاهش سایز FET از کانال نیمه رسانایی که با استفاده از
نانوفیبر (از جنس پلیمر رسانا یا اکسید فلز) ساخته شده،
استفاده می شود (شکل 10). برای مثال Park و همکارانش برای
ساخت سنسور دوپامین از گیرنده دوپامین انسانی (hDRD 1)
کنژوگه شده برروی نانوفیبرهای پلیمری رسانا استفاده کردند.
این FET ساخته شده براساس کربن نانوفیبر در کمتر از دو
ثانیه پاسخ می دهد و عملکردی با دقت و حساسیت بالا
دارد[20].
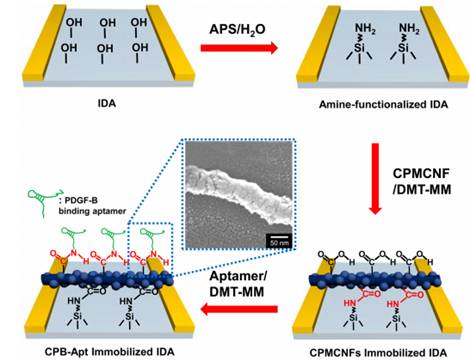
(شکل 10) پروتوکل تثبیت
CPMCNF-مبدل آپتامر روی آرایه ی الکترود جهت تشخیص فاکتور
رشد مشتق شده از پلاسما [18]
محققان از نانوفیبرهای الکتروریسی شده ی PLGA برای ساخت
سنسور شیمیای استفاده کرده اند. نانوفیبرهای الکتروریسی
شده ی فلوئورسنت یکی دیگر از گزینه هایی است که پتانسیل
بالایی در ساخت سنسور دارد. ساختار متخلخل وب نانوفیبری
برای شناسایی مواد بیوشیمیایی ایده آل است. همانطور که در
شکل 11 نشان داده شده است از پلی اتیلن دی اکساید تیوفن (PETDOT)،
یک پلیمر رسانا، برای تثبیت آنزیم گلوکز روی آرایه ی
میکروالکترود جهت تشخیص گلوکز استفاده شده است. برای
مقایسه فیلم PEDOT نیز بررسی شد و همچنین بر روی ساختار
فیبری PLLA قرار داده شد. هر دوی بیوسنسورها پاسخ خطی به
محلول گلوکز (غلظت 25-1/0 مولار) داشتند و حساسیت سنسور
PEDOT پوشش داده شده روی PLLA حساسیت بیشتر، محدوده ی
تشخیص گسترده تر و پایداری بالاتری در مقایسه با فیلم نشان
داد[21].
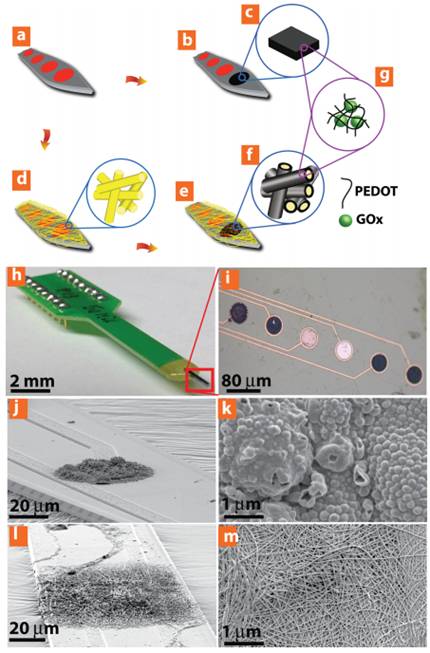
(شکل 11) تصویر شماتیکی از
فرایند ساخت PEDIO ادغام شده با آنزیم گلوکز اکسیداز بر
روی آرایه ی میکروالکترود .a) آرایه میکروالکترود پلاتینی
b.c) لایه نشانی الکتریکی آنزیم گلوکزاکسیداز ادغام شده با
فیلم PEDOT .c) الکتروریسی نانوفیبرهای PLLA روی آرایه
میکروالکترود. d.f) لایه نشانی الکتریکی PETOD بر روی
نانوفیبرها جهت تشکیل نانوفیبرهای PEDOTادغام شده با آنزیم
GOx. H) میکروگراف نوری برای آرایه ی کلی میکروالکترود i)
میکروگراف نوری الکترود که دو جایگاه پوشش داده نشده
پلاتین و چهار جایگاه انزیم ادغام شده با PEDOT را نشان
می دهد. J) تصویر میکروسکوپی از PEDOT F-Gox . k) تصویر با
بزرگنمایی بالاتر از نمونه قبلی. l) تصویر میکروسکوپی از
PEDOT NFs-GOx . m) تصاویر نمونه قبلی (l) با بزرگنمایی
بالاتر[21]
در جدول زیر تعدادی از مطالعات انجام شده برای ساخت
بیوسنسورهایی برپایه نانوفیبر آورده شده است
Application of electrospun nanofiber based
electrodes in biosensing
Nanofibrous
Electrode |
Fiber
diameter (nm) |
Analyte |
Linear range (�M) |
Sensitivity |
Detection limit (�M) |
Ref |
|
ZnO/GOx |
100 |
Glucose |
- |
69 μA/mMcm-2 |
10 |
Huang
et al |
|
CuO/Pd |
90-140 |
Glucose |
0.2-2500 |
1061.4 μAmM−
1
cm− |
0.019 |
Wang al. |
Carbon
doped TiO2/
Graphene
foam |
72 |
Breast cancer biomarkers ( ErbB2) |
0.000001 –
0.1 |
123.5 kΩ pM–1 |
0.000001 |
Ali et
al. |
|
poly(3,4-ethylenedioxythiophene)-FET |
100 |
Dopamine |
- |
- |
100 fM |
Park et al. |
|
Polypyrrole-coated metal oxide-decorated
carbon nanofibers
(CPMCNFs)-FET |
40 |
Platelet-derived growth
factor (PDGF) |
- |
- |
5 fM |
Jun et al. |
5-پوشش
زخم
پوست بزرگترین ارگان بدن انسان است که نقش های مهمی همچون
تنظیم آب، دما و الکترولیت های بدن را برعهده دارد. پوست
از سه لایه شامل اپیدرم، درم و هایپودرم تشکیل شده است.
اپیدرم لایه بیرونی پوست می باشد که نقش دفاعی در برابر
ورود عوامل بیماری زا به بدن را ایفا می کند. درم در زیر
اپیدرم قرار دارد و از بافت های متصل کننده ساخته شده است
و مسئول رفتار مکانیکی پوست است. هایپودرم داخلی ترین لایه
پوست است که منجر به اتصال پوست با عضلات و استخوان ها
می شود( شکل 12). [22].
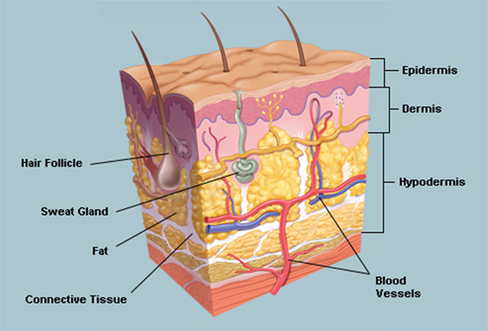
(شکل 12) لایه های مختلف
پوست
در صورت آسیب به پوست و ایجاد زخم راه برای نفوذ باکتری ها
و سایر عوامل بیماری زا باز می شود. مواد مختلفی برای پوشش
دهی زخم استفاده می شود تا آلودگی ها از زخم دور شود و
شرایطی فراهم شود که زخم بهبود یابد و عفونت نکند. در
گذشته برای پوشش زخم از عسل، چربی حیوانات و فیبرهای گیاهی
استفاده می شد. امروزه پوشش های زخم ساده فاقد اثر درمانی
مانند گازاستریل ساخته می شود که فقط روی زخم را می پوشاند
و مانع از آسیب به زخم و ورود میکروب ها به زخم می شود در
حالیکه اجازه می دهد که اکسیژن و فلوئیدها برای بهبود زخم
تبادل شود. یکی دیگر از انواع پوشش های زخم (مانند
هیدروکولوئید ها) می تواند یک محیط مرطوب و مناسب را برای
درمان زخم ایجاد کند. اخیرا با توسعه مواد بیوپلیمری،
تکنیک های ساخت و توانایی ادغام مواد بیواکتیو، پوشش های
زخمی ایجاد شده اند که مانع از عفونت می شوند و درمان زخم
را تسریع می کنند[23].
بسته به نوع زخم و موارد لازم برای بهبود آن، پوشش زخم
باید متفاوت باشد. از مهمترین ویژگی های پوشش زخم می توان
به این موارد اشاره کرد:
• حفظ رطوبت اطراف زخم
• حذف کردن ترشحات
• ممانعت از ورود میکروارگانیسم ها به زخم
• ایجاد شرایط مناسب برای تبادل گازها
• عدم ایجاد سمیت و آلرژی در بدن شخص
• عدم اتصال و چسپندگی به سلول (عدم ایجاد آسیب بعد از
جداکردن از روی زخم)
• افزایش سرعت بهبود زخم [24]
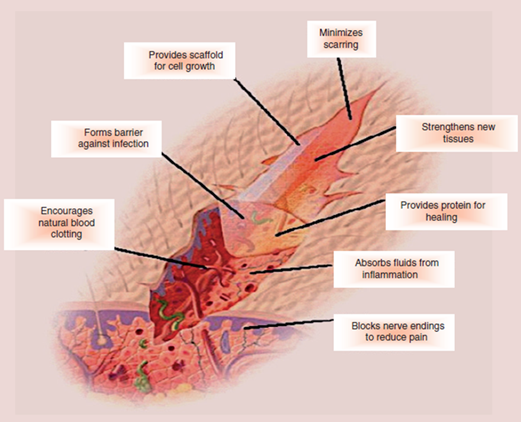
(شکل 13) نیازهای یک پوشش
زخم ایده آل[24]
1-5 انواع پوشش های زخم
انتخاب پوشش زخم به نوع زخم و نیاز بیمار برای درمان بستگی
دارد. پوشش های زخم را می توان در سه دسته تقسیم کرد:
• Passive
• Interactive
• Advanced and bioactive
نمونه های passive که همان گاز استریل معمول می باشد که
کمترین اثر را دارد و فقط روی زخم را پوشش می دهد تا زخم
خودش بهبود پیدا کند. مواد interactive مانند هیدروژل ها و
فوم ها تقریبا شفاف هستند و شرایط مناسبی را برای نفوذ آب
و اکسیژن فراهم می کنند. مواد bioactive مانند کلسیم
آلژینات، هیدروکلوئیدها و کلاژن نتایج مثبتی را در درمان
زخم نشان داده اند[25, 26].
2-5 نانوفیبرها در پوشش زخم
نانوفیبر با توجه به شبیه سازی ساختارهای نانومتری بافتی
که در حال بهبود است، برای پوشش زخم گزینه-ی مناسبی هستند.
ساختار نانوفیبرها با ویژگی های منحصر به فردشان، سازگاری
آن ها را با بافت زخم افزایش داده و باعث بهتر شدن و سرعت
بخشیدن به بهبود زخم می شود (در مقایسه با پوشش های زخم
معمول). یک پوشش زخم ایده آل باید بتواند ساختار پوست را
شبیه سازی کند، نانوفیبرها به خاطر ویژگی-های فیزیکی که
دارند می تواند ساختاری مشابه ماتریکس خارج سلولی ایجاد
کنند. همانطور که می دانیم ماتریکس خارج سلولی با فراهم
آوردن محیطی برای اتصال سلول و تکثیر آن، در بهبود زخم
اهمیت بسزایی دارد. پس نانوفیبرها با شبیه سازی این ساختار
تکثیر و مکانیسم های ترمیم را سرعت می بخشند[27].
3-5 مزایای استفاده از نانوفیبر به عنوان پوشش زخم
هموستاز
نانوفیبرهای الکتروریسی شده به علت ساختار نانویی، نسبت
سطح به حجم بالایی دارند. براین اساس می-توانند منجر به
افزایش هموستاز در محل زخم شوند. همچنین می توان با افزودن
عامل انعقادی خون به نانوفیبر مانع از عوارش جانبی آن در
بدن شد[27].
جذب مواد ترشحی زخم
جذب مواد ترشحی زخم یکی از مهمترین موارد برای پوشش زخم
است. نانوفیبرها نسبت به فیلم پلیمری (از همان جنس) قادر
به جذب آب بین 18 تا 213 درصد بیشتر هستند. این ویژگی
همچنین مانع از خشک شدن زخم می شود.
حفظ رطوبت محیط و نفوذپذیری
نانوفیبرها محیطی مرطوب را برای تنفس، تکثیر و زنده ماندن
سلول ها فراهم می کند. ساختار متخلخل مش نانوفیبری نه تنها
مانع از عفونت می شود (بعلت سایز کوچک منافذ) بلکه نفوذ
پذیری را برای گازها فراهم می-کند که مانع از دهیدراته شدن
بافت می شود[27].
رهایش کنترل شده ی دارو
تکنیک های مختلف ساخت نانوفیبر ازجمله الکتروریسی اجازه
ترکیب داروهای مختلف را با نانوفیبر می دهد تا دارو در محل
زخم رهایش یابد. نوع دارو بسته به نیاز زخم و درمان آن
متفاوت است. برای مثال افزودن مواد آنتی باکتریال، ضدقارچی،
فاکتور رشد و ویتامین[27].
انعطاف پذیری مت نانوفیبری
پوشش زخم برای راحتی، بیمار باید انعطاف پذیر باشد.
پوشش های زخم نانوفیبری این ویژگی را بخوبی فراهم
می کنند[27].
عدم ایجاد جای زخم
اگرچه دست یابی به این ویژگی به راحتی میسر نیست، با این
حال دانشمندان در تلاشند تا با استفاده از نانوفیبرها
پوشش های زخمی تولید کنند که جای زخم را به کمترین حد خود
برساند. یک دانشمند پوشش زخم نانوفیبری الکتروریسی شده ای
را ساخت که منجر به رشد سریع بافت پوست نرمال می شود. زیرا
نانوفیبرها زیست سازگار بوده و مسیر بهبود زخم را بخوبی
فراهم کرده اند. نانوفیبرهای الکتروریسی شده ساختار پوست
را شبیه سازی می کنند و بیشترین سازگاری را با خون دارند
که در نهایت منجر به بازسازی بافت آسیب دیده می شوند. در
زیر تصویری از پوشش زخم درست شده از نانوفیبر آورده شده
است[27].
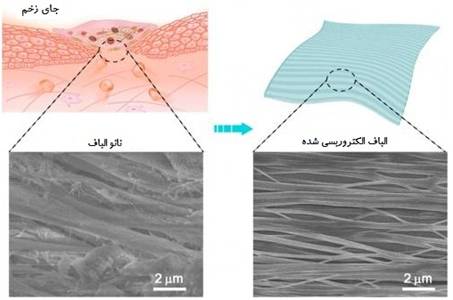
(شکل 14) استفاده از فیبرهای
الکتروریسی شده برای ساخت پوشش زخم
موادی که می توان در ساخت پوشش زخم از آن استفاده کرد
عبارتنداز: کیتوزان، ابریشم، ژلاتین، پلیمرهایی شامل PVA،
PVA/gum tragacanth، PVA/keratin، PVP، PAA، مواد آنتی
باکتریال، ویتامین ها، فاکتور رشد و فلز و اکسید فلز[28].
در زیر جدولی از مواد درمانی لود شده در نانوفیبر برای
ساخت پوشش زخم آورده شده است.
|
Electrospun polymer fiber |
Therapeutic agent |
|
Silk
fibroin/vitamin C 2-phosphate |
Vitamin C
2-phosphate |
|
Polycaprolactone/polyethylene
glycol |
Basic fibroblast
growth factor/epidermal growth factor |
|
Poly(vinyl
alcohol)/poly(vinyl acetate) |
Ciprofloxacin |
|
Chitosan/polyethylene
oxide/chitin nanocrystals |
Chitosan |
|
Silk fibroin/poly(lactide-co-glycolic
acid) |
Silk fibroin |
|
Silk fibroin/polyethylenimine |
Silk fibroin |
|
Gelatin/poly(vinyl
alcohol) |
Raspberry ketone |
|
Gelatin/poly(l-lactide)
|
- |
|
Gelatin |
- |
|
Poly(vinyl
alcohol)/chitosan |
- |
|
Poly(vinyl
alcohol)/gum tragacanth |
- |
|
Poly(vinyl
alcohol)/keratin |
- |
|
Poly(vinyl
alcohol)/poly(vinyl pyrrolidone) |
- |
|
Poly(vinyl
alcohol)/poly(vinyl pyrrolidone)/chitosan |
Chitosan |
|
Poly(vinyl
alcohol)/poly(vinyl pyrrolidone)-iodine |
Poly(vinyl
pyrrolidone)-iodine |
|
Poly(vinyl
alcohol)/poly(acrylic acid) |
- |
|
Poly(vinyl
alcohol)/poly(acrylic acid)/poly(vinyl
pyrrolidone) |
- |
|
Poly(vinyl
alcohol)/poly(acrylic acid)/poly(vinyl
pyrrolidone)-
iodine |
Poly(vinyl
pyrrolidone)-iodine |
|
Poly(vinyl
alcohol)/poly(acrylic acid)/chitosan |
Chitosan |
|
Poly(vinyl
alcohol)/poly(vinyl pyrrolidone)-iodine/Poloxamer188 |
Poloxamer 188 |
|
Poly(vinyl
alcohol)/poly(vinyl pyrrolidone)-iodine/chitosan |
Chitosan |
|
Poly(vinyl
alcohol)/polypropylene glycol |
- |
|
Poly(vinyl
alcohol)/polyethylene glycol |
- |
|
Silk
fibroin/vitamin E |
Vitamin E |
|
poly(e-caprolactone)-poly(ethyleneglycol)-poly(ecaprolactone) |
EGF |
|
Poly(vinyl
alcohol) |
Silver
nanoparticles |
|
Poly(vinyl
alcohol)/chitosan |
Silver
nanoparticles |
|
Polysulfone |
Polyethyleneimine-capped
silver nanoparticles |
|
Polyurethane |
Silver
nanoparticles |
|
Poly(vinyl
pyrrolidone) |
Titanium dioxide |
|
Poly(vinyl
alcohol) |
Titania doped
with zinc |
|
Poly(vinyl
alcohol)/sodium alginate |
Zinc oxide |
|
Poly
lactic-co-glycolic acid |
Silver
nanoparticles |
|
Polyurethane-dextran |
Ciprofloxacin HCl |
|
Polycaprolactone |
Collagen |
ترکیب پلیمرهای سنتزی با
پلیمرهای طبیعی منجر به عاملدار شدن بیولوژیکی نانوفیبرهای
تولید شده می-شود. کلاژن، ژلاتین، کیتوزان و .. به عنوان
عوامل افزاینده چسپندگی و تکثیر سلولی شناخته شده اند.
عاملدار کردن بیولوژیکی نانوفیبرها با استفاده از
لیگاندهای فعال و سلول نیز در حال بررسی و مطالعه است.
روش های مختلفی برای عاملدار کردن بیولوژیکی نانوفیبرها
وجود دارد که در جدول زیر خلاصه شده است. در الکتروریسی
ترکیبی، فاکتورهای رشد و مولکول های زیست فعال با محلول
پلیمری قبل از الکتروریسی ترکیب می شوند. نانوفیبرهای
هسته-پوسته با استفاده از نیدل های coaxial ساخته می شوند.
پلیمری که در هسته قرار می گیرد معمولا دارای مولکول های
زیست فعال است. پوسته نیز پلیمری است که از ماده هسته در
برابر شرایط سخت محافظت می کند و رهایش را میسر می کند.
ساخت این گونه الیاف با دو پمپ سرنگی کنترل می شود تا از
امتزاج محلول ها قبل از تشکیل فیبر اطمینان حاصل شود.
نانوفیبرهای هسته-پوسته نیز همانند نانوفیبرهای معمولی تحت
تایثیر پارمترهای دستگاه و پارمترهای محیطی قرار می گیرند.
بنابراین با وارد کردن مواد زیستی در ترکیب نانوفیبر
می توان به نتایج بهتر در مهندسی بافت دست یافت[28].
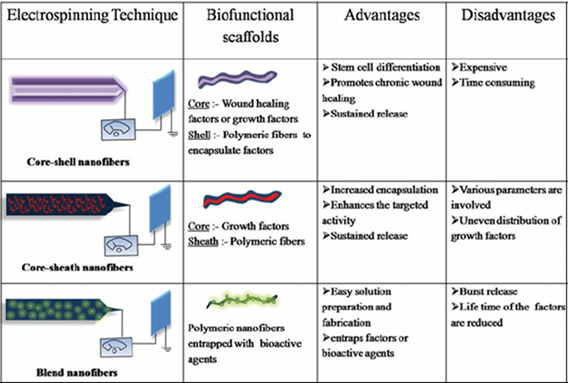
(شکل 15) روش های افزودن
مواد زیست فعال به نانوفیبرهای الکتروریسی شده [8]
نتیجه گیری
نانوفیبرها به علت ویژگی های خاصی از جمله نسبت سطح به حجم
و تخلخل بالا کاربردهای زیادی در زمینه پزشکی دارند. برای
مثال از نانوفیبرها در مهندسی بافت، ساخت بیوسنور، پوشش
زخم، دارو رسانی و ساخت پروتزهای پزشکی استفاده می شود. با
توجه به کاربرد مورد نظر می توان از پلیمرهای مختلفی برای
ساخت فیبر بهره برد. همچنین سایر ویژگی های فیزیکی فیبر
نیز می تواند به راحتی با استفاده از الکتروریسی تغییر
داده شده و کنترل شود تا محصول مورد نظر با بهترین کارایی
و عملکرد ساخته شود.
References
1. Sridhar, R., et al., Electrospun nanofibers for
pharmaceutical and medical applications. Journal of Drug
Delivery Science and Technology, 2011. 21(6): p.
451-468.
2. Eatemadi, A., et al., Nanofiber: synthesis and
biomedical applications. Artificial cells, nanomedicine,
and biotechnology, 2016. 44(1): p. 111-121.
3. Kelleher, C.M. and J.P. Vacanti, Engineering
extracellular matrix through nanotechnology. Journal of
The Royal Society Interface, 2010: p. rsif20100345.
4. Huang, L., R.P. Apkarian, and E.L. Chaikof,
High‐resolution analysis of engineered type I collagen
nanofibers by electron microscopy. Scanning, 2001.
23(6): p. 372-375.
5. Cooper, A., et al., Aligned chitosan-based nanofibers
for enhanced myogenesis. Journal of Materials Chemistry,
2010. 20(40): p. 8904-8911.
6. Webster, T.J., R.W. Siegel, and R. Bizios, Osteoblast
adhesion on nanophase ceramics. Biomaterials, 1999.
20(13): p. 1221-1227.
7. Zhang, Y., et al., Biomimetic and bioactive nanofi
brous scaffolds from electrospun composite nanofibers.
International journal of nanomedicine, 2007. 2(4): p.
623.
8. Sundaramurthi, D., U.M. Krishnan, and S. Sethuraman,
Electrospun nanofibers as scaffolds for skin tissue
engineering. Polymer Reviews, 2014. 54(2): p. 348-376.
9. Liao, I.-C. and K.W. Leong, Efficacy of engineered
FVIII-producing skeletal muscle enhanced by growth
factor-releasing co-axial electrospun fibers.
Biomaterials, 2011. 32(6): p. 1669-1677.
10. Yang, Y., et al., Core–sheath structured fibers with
pDNA polyplex loadings for the optimal release profile
and transfection efficiency as potential tissue
engineering scaffolds. Acta biomaterialia, 2011. 7(6):
p. 2533-2543.
11. Zou, B., et al., Electrospun fibrous scaffolds with
continuous gradations in mineral contents and biological
cues for manipulating cellular behaviors. Acta
biomaterialia, 2012. 8(4): p. 1576-1585.
12. Schneider, A., et al., Biofunctionalized electrospun
silk mats as a topical bioactive dressing for
accelerated wound healing. Acta Biomaterialia, 2009.
5(7): p. 2570-2578.
13. He, W., et al., Tubular nanofiber scaffolds for
tissue engineered small‐diameter vascular grafts.
Journal of biomedical materials research Part A, 2009.
90(1): p. 205-216.
14. Gaudio, C., et al., Are synthetic scaffolds suitable
for the development of clinical tissue‐engineered
tubular organs? Journal of Biomedical Materials Research
Part A, 2014. 102(7): p. 2427-2447.
15. Clark, L.C. and C. Lyons, Electrode systems for
continuous monitoring in cardiovascular surgery. Annals
of the New York Academy of sciences, 1962. 102(1): p.
29-45.
16. Ding, B., et al., Electrospun nanomaterials for
ultrasensitive sensors. Materials Today, 2010. 13(11):
p. 16-27.
17. Gupta, R.K., et al., Label-free detection of
C-reactive protein using a carbon nanofiber based
biosensor. Biosensors and Bioelectronics, 2014. 59: p.
112-119.
18. Jun, J., et al., Aptamer-functionalized hybrid
carbon nanofiber FET-type electrode for a highly
sensitive and selective platelet-derived growth factor
biosensor. ACS applied materials & interfaces, 2014.
6(16): p. 13859-13865.
19. Ali, M.A., et al., Anti-epidermal growth factor
receptor conjugated mesoporous zinc oxide nanofibers for
breast cancer diagnostics. Nanoscale, 2015. 7(16): p.
7234-7245.
20. Park, S.J., et al., Human dopamine
receptor-conjugated multidimensional conducting polymer
nanofiber membrane for dopamine detection. ACS Applied
Materials & Interfaces, 2016. 8(42): p. 28897-28903.
21. Yang, G., K.L. Kampstra, and M.R. Abidian, High
performance conducting polymer nanofiber biosensors for
detection of biomolecules. Advanced Materials, 2014.
26(29): p. 4954-4960.
22. Gaffal, E., et al., Cannabinoid 1 receptors in
keratinocytes modulate proinflammatory chemokine
secretion and attenuate contact allergic inflammation.
The Journal of Immunology, 2013. 190(10): p. 4929-4936.
23. Abrigo, M., S.L. McArthur, and P. Kingshott,
Electrospun nanofibers as dressings for chronic wound
care: advances, challenges, and future prospects.
Macromolecular Bioscience, 2014. 14(6): p. 772-792.
24. Jayakumar, R., et al., Biomaterials based on chitin
and chitosan in wound dressing applications.
Biotechnology advances, 2011. 29(3): p. 322-337.
25. Vowden, K. and P. Vowden, Wound dressings:
principles and practice. Surgery (Oxford), 2014. 32(9):
p. 462-467.
26. Li, C., et al., Silver nanoparticle/chitosan
oligosaccharide/poly (vinyl alcohol) nanofibers as wound
dressings: a preclinical study. International journal of
nanomedicine, 2013. 8: p. 4131.
27. Zhang, Y., et al., Recent development of polymer
nanofibers for biomedical and biotechnological
applications. Journal of Materials Science: Materials in
Medicine, 2005. 16(10): p. 933-946.
28. Hassiba, A.J., et al., Review of recent research on
biomedical applications of electrospun polymer
nanofibers for improved wound healing. Nanomedicine,
2016. 11(6): p. 715-737.