الکتروفورز مویین دارای
انواع مختلفی می�باشد. در بسیاری از موارد برای
جداسازی یک گونه�ی خاص می�توان بیش از یک نوع را به
کار گرفت. یکی از مزیت�های اصلی الکتروفورز مویین این
است که معمولاً با تغییر ترکیب الکترولیت به سادگی
می�توان تکنیک�های مختلف را با استفاده از یک لوله�ی
مویین در آنالیزهای مختلف انجام داد. درحالی�که در
تکنیک HPLC برای تغییر نوع تکنیک اغلب به تغییر فاز
متحرک و نیز تغییر ستون احتیاج است. در ادامه به شرح
مختصری از هر یک از انواع تکنیک�های الکتروفورز مویین
پرداخته می�شود.
الکتروفورز مویین
منطقه�ای[1]
(CZE)
یکی از پرکاربردترین
انواع الکتروفورز مویین می�باشد. مکانیزم به کارگرفته
شده در الکتروفورز مویین منطقه�ای، امکان جداسازی
مخلوطی از کاتیون�ها و آنیون�ها را هم�زمان در یک
آنالیز مهیا می�سازد، اما جداسازی گونه�های خنثی از
یکدیگر امکان�پذیر نمی�باشد. در این روش لوله�ی مویین
از یک نوع الکترولیت پر شده و سپس نمونه به درون آن
تزریق می�گردد و بار دیگر لوله�ی مویین در ظرفی از
همان الکترولیت قرار می�گیرد. در شکل 1 ترتیب جداسازی
با استفاده از این تکنیک نمایش داده شده است. نمونه
اغلب از سمت آند تزریق شده و با توجه به این�که جریان
الکترواسمزی به سمت کاتد می�باشد، تمام اجزای
تشکیل�دهنده�ی نمونه در یک جهت و به سمت کاتد مهاجرت
خواهند کرد. در عین حال هر جزء با توجه به تحرک
الکتروفورتیک مربوط به خود با سرعت متفاوتی مهاجرت
می�نماید و در نهایت برآیند جریان الکترواسمزی و تحرک
الکتروفورتیک اجزای تشکیل�دهنده�ی نمونه را به صورت
باندهای مجزا، تفکیک می�کند. ترتیب مهاجرت گونه�ها
براساس نسبت بار به اندازه می�باشد. به این ترتیب که
یون�های کوچکتر و دارای بار بیشتر سریعتر از سایر
یون�ها مهاجرت می�کنند. بیشترین سرعت مهاجرت مربوط به
کاتیون�های کوچک�تر و دارای بار بیشتر و کمترین سرعت
مهاجرت مربوط به آنیون�های کوچکتر و دارای بار بیشتر
می�باشد. ذرات خنثی با سرعتی برابر با سرعت جریان
الکترواسمزی مهاجرت کرده و بنابراین از یکدیگر جدا
نخواهند شد. اگر قطبیت الکترودها برای تسریع آنالیز
آنیون�ها تعویض گردد، ترتیب خروج گونه�ها بر عکس حالت
ذکر شده در بالا خواهد شد.
کروماتوگرافی
الکتروسینتیکی مایسلی[2]
(MEKC)
یکی از کاستی�های عمده
در CZE عدم توانایی این تکنیک در جداسازی گونه های
خنثی از یکدیگر می�باشد. با استفاده از تکنیک
کروماتوگرافی الکتروسینتیکی مایسلی می�توان این نقص را
برطرف نموده و هم�زمان ذرات خنثی و یون�ها را جداسازی
نمود. اساس این تکنیک بر پایه�ی توزیع آنالیت بین دو
فاز مایسلی و محلول الکترولیت استوار است. بنابراین
می�توان این تکنیک را نظیر HPLC در نظر گرفت. اگرچه در
MEKC با بهره�گیری از جریان الکترواسمزی امکان
جداسازی�های با کیفیت بیشتر فراهم می�شود. مایسل را در
این تکنیک می�توان یک شبه فاز ساکن[3]
در نظر گرفت. تشکیل مایسل از طریق افزودن یک سورفکتانت
به الکترولیت زمینه در غلظتی بالاتر از غلظت بحرانی
مایسل[4]
(CMC) انجام می�شود. غلظت بحرانی مایسل به صورت کمترین
غلظتی از سورفکتانت که ایجاد مایسل نماید، تعریف
می�شود. مولکول�های سورفکتانت دارای یک دنباله�ی بلند
آب�گریز و سری باردار می�باشند. یک مایسل تجمعی از
مولکول�های سورفکتانت به شکل کروی می�باشد، به نحوی که
دنباله�های آب�گریز به طرف مرکز کره و سرهای باردار به
سمت بیرون (الکترولیت زمینه) جهت�گیری کرده�اند. در
شکل 2 تصویری از یک مایسل قابل مشاهده است. مایسل�های
ایجاد شده دارای باری هستند که سرعت مهاجرت آن�ها را
نسبت به جریان الکترواسمزی تحت تاثیر قرار می�دهد.
جداسازی مواد بی�بار به میزان توزیع این مواد بین
مایسل�ها و الکترولیت بستگی دارد. مواد بی�بار آب�دوست
تمایلی به مایسل�ها ندارند. درحالی�که مواد بی�بار
آب�گریز در داخل مایسل�ها محبوس شده و بدین�ترتیب
جداسازی آن�ها امکان�پذیر می�گردد. به طور کلی بهترین
جداسازی برای مواد بی�باری که به نسبت�های متفاوت بین
مایسل�ها و بافر توزیع شده�اند، حاصل می�گردد.
پرکاربردترین سورفکتانت
مورد استفاده در این تکنیک، سدیم دودسیل سولفات[5]
(SDS) است که دارای یک سر باردار منفی می�باشد.
تنها محدودیت این روش در
مورد وزن مولکول�هاست که باید کوچکتر از 5000 دالتون
باشد. این محدودیت در CZE وجود ندارد.
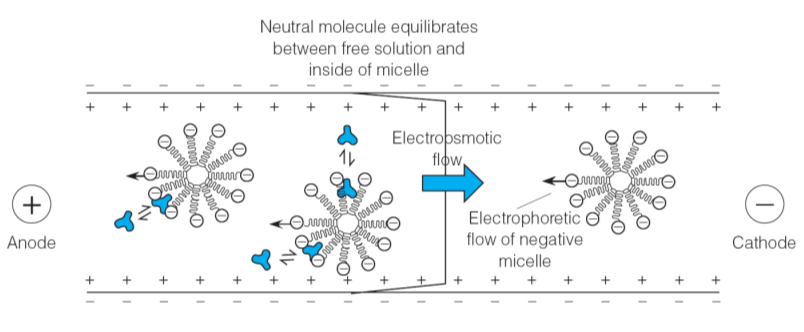
شکل 2 - شمایی از
مایسل�ها و نحوه�ی توزیع گونه بین مایسل�ها و آنالیت.
الکتروفورز ژل
مویینه�ای[6]
(CGE)
الکتروفورز ژل مویینه�ای
با استفاده از یک لوله�ی مویین پر شده با ژل صورت
می�گیرد. متداول�ترین نوع ژل به کارگرفته شده در
الکتروفورز پلی�آکریل�آمید[7]
می�باشد. ژل دارای خلل و فرج�هایی می�باشد که امکان
جداسازی گونه�های باردار با اندازه�ی متفاوت را از
طریق مکانیزم غربال مولکولی فراهم می�آورد. از
آن�جایی�که اساس این نوع جداسازی بر پایه�ی اندازه�ی
گونه�ها می�باشد، این روش برای گونه�هایی با تحرک
الکتروفورتیک یکسان و با اندازه�ی متفاوت (گونه�هایی
که نسبت بار به اندازه�ی یکسان دارند)، مناسب است. به
عنوان مثالی از این گونه�ها می�توان به
الیگونوکلئوتیدها[8]
اشاره کرد.
از آن�جایی�که ژل
پرکننده�ی لوله�ی مویین راکد می�باشد، امکان شستشوی
مناسب در بین آنالیزها مهیا نبوده و بنابراین این نوع
لوله�های مویین دارای عمر محدودی می�باشند. به علاوه
در این روش تنها می�توان از شیوه�ی تزریق
الکتروسینتیکی استفاده کرد (به دلیل مقاومت ژل در
برابر تزریق هیدرودینامیکی).
تمرکز ایزوالکتریک
مویینه�ای[9]
(CIEF)
این تکنیک عمدتاً در
جداسازی گونه�های آمفوتر کاربرد دارد. آمفوتر گونه�ای
است که می�تواند هر دو شکل کاتیونی و آنیونی را (وابسته
به pH) به خود بگیرد. به pH ای که در آن گونه�ی آمفوتر
به صورت خنثی در می�آید، نقطه�ی ایزوالکتریک (Ip[10])
گویند. در pH های بالاتر این گونه�ها به صورت کاتیونی
در می�آیند و برعکس. برای جداسازی این گونه�ها لوله�ی
مویین را از الکترولیتی که حاوی ترکیبات آمفوتر
می�باشد، پر می�کنند. سپس آند در محلول یک اسید قوی و
کاتد در محلولی از بازی قوی قرار می�گیرد. با اعمال
پتانسیل پروتون�ها به سمت کاتد و یون�های هیدروکسید به
سمت آند مهاجرت می�کنند و هم�زمان گونه�های آمفوتر نیز
شروع به مهاجرت می�نمایند و با پیش�روی به سمت کاتد یا
آند، در نهایت در منطقه�ای از مویین، بار آن�ها خنثی
شده و متوقف می�گردند. نتیجه�ی نهایی ایجاد یک سری از
نوارهای مجزا می�باشد که برای آشکارسازی با اعمال فشار
به سمت دتکتور رانده می�شوند.
ایزوتاکوفورز مویین[11]
(CITP)
اگرچه این نوع از
الکتروفورز در واقع اولین نوع تجاری قابل دسترس محسوب
می�شود اما امروزه به ندرت به کار گرفته می�شود. زیرا
این روش قادر به جداسازی کاتیون�ها و آنیون�ها،
هم�زمان در یک آنالیز نمی�باشد. .همان�گونه که در شکل
3 مشاهده می�گردد، در این روش از یک سیستم بافری
غیرهمگن استفاده می�گردد که متشکل از یک بافر جلودار[12]
(حاوی یون�های با تحرک بیشتر از یون�های آنالیت) ویک
بافر پایان�رسان[13]
(حاوی یون�های با تحرک کمتر از یون�های آنالیت)
می�باشد. در این روش نمونه مابین بافر جلودار و بافر
پایان�رسان تزریق می�گردد. با اعمال پتانسیل یون�های
آنالیت همانند CZE با سرعت متفاوت شروع به مهاجرت کرده
و نوارهایی از یون�های آنالیت ایجاد می�گردد. با این
تفاوت که در این�جا نوارهای آنالیت به هم چسبیده�اند و
مانند CZE با نوارهای بافری از هم جدا نشده�اند.
شکل داده�ی خروجی در این
روش بسیار متفاوت از سایر روش�ها می�باشد. داده�ی
خروجی که اصطلاحاً ایزوتاکوفروگرام[14]
نامیده می�شود متشکل از پله�هایی با طول متفاوت
می�باشد که طول هر یک متناسب با غلظت گونه�ی مربوطه در
آنالیت می�باشد.
در حال حاضر عمده�ترین
کاربرد این نوع الکتروفورز به عنوان مرحله�ی پیش�تغلیظ
برای جداسازی با CZE می�باشد.

شکل 3-شمایی از جداسازی
با استفاده از تکنیک ایزوتاکوفورز مویین.
الکتروکروماتوگرافی
مویین[15]
(CEC)
در این تکنیک لوله�ی
مویین با استفاده از یک فاز ساکن کروماتوگرافی پر شده
است و اساس جداسازی بر پایه�ی توزیع گونه�ها بین فاز
متحرک و فاز ساکن استوار است. این تکنیک ترکیبی از
الکتروفورز و HPLC می�باشد. لذا دارای مزایای هر دو
روش است که از جمله�ی آن�ها می�توان به صاف بودن
نیم�رخ جریان که منجر به کارایی بالاتر جداسازی
می�گردد، اشاره کرد. به علاوه همانند HPLC در این روش
امکان جداسازی گونه�های بدون�بار وجود دارد.
[1]Capillary
zone electrophoresis
[2]
Micellar electrokinetic chromatography
[3]
Pseudo stationary phase
[4]
Critical micelle concentration
[5]
Sodium dodecyl sulfate
[6]
Capillary gel electrophoresis
[9]
Capillary isoelectric focusing
[11] Capillary isotachophoresis
[15] Capillary electrochromatography